1. Définition
Les alcanes sont des hydrocarbures saturés.
Les alcanes non cycliques ont pour formule brute CnH(2n+2).
2. Les différentes catégories des alcanes
Il existe plusieurs catégories d’alcanes :
3. Nomenclature
Le nom d’un alcane dépend de son nombre des carbones. Pour les alcanes linéaires, ça commence par un préfixe grec indiquant le nombre des carbones et se termine par le suffixe ane.
Exemples :
| Nombre des carbones | préfixe | Nom de l’alcane | Formule brute |
| 1 | méth- | méthane | CH4 |
| 2 | éth- | éthane | C2H6 |
| 3 | prop- | propane | C3H8 |
| 4 | but- | butane | C4H10 |
| 5 | pent- | pentane | C5H12 |
| 6 | hex- | hexane | C6H14 |
| 7 | hept- | heptane | C7H16 |
| 8 | oct- | octane | C8H18 |
| 9 | non- | nonane | C9H20 |
| 10 | déc- | décane | C10H22 |
Le nom d’un alcane cyclique commence par le préfixe cyclo.
Exemple : cyclohexane (C6H12)
Pour nommer un alcane ramifié, on commence par trouver et puis numéroter la plus longue chaîne de carbone. Le carbone numéro 1 sera le plus proche de la première ramification.
Puis on regarde la position de chaque substituant. On nomme ensuite la chaîne ayant les plus de carbones comme un alcane. Et on ensemble tout pour former le nom : le numéro du carbone auquel est rattaché le groupe alkyle en premier puis le nom d’alkyle en second puis suivi du nom d’alcane. S’il y a plusieurs alkyles, on doit respecter l’ordre alphabétique. S’il existe plusieurs alkyles identiques, on utilise di (pour deux), tri (pour trois) etc.
Exemple :
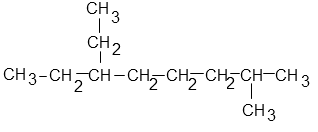
Ici on voit que la chaîne ayant le plus de carbone a 8 carbones. Donc nous avons un octane.
Pour les numérotations des carbones, on procédera d’une de ces façons (numérotation en rouge):
Première possibilité :
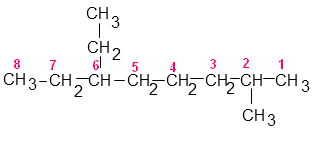
Deuxième possibilité :
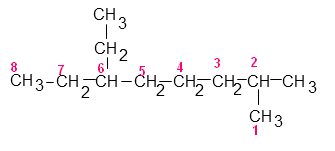
Troisième possibilité :
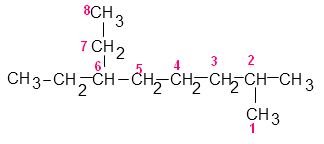
Quatrième possibilité
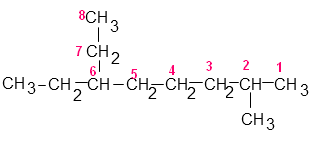
Quelque soit la possibilité, on voit très bien que nous avons un groupe méthyle (CH3) sur le carbone numéro 2. Nous avons ensuite un groupe éthyle (CH3-CH2) sur le carbone 6.
Donc le nom de l’alcane est 6-éthyl-2-méthyloctane.
4. Formule Développée et formule semi-développée d’un alcane
Prenons l’exemple de l’éthane : formule brute C2H6.
Formule développée :
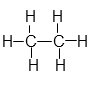
Formule semi-développée :
CH3-CH3
5. La combustion des alcanes
Les alcanes sont des matières organiques très combustibles. Ils existent à l’état liquide (comme le pétrole), à l’état gazeux (comme le butane) et à l’état solide.
Leur combustion peut être soit complète ou incomplète.
La combustion complète d’un alcane produit de l’eau et du dioxyde de carbone.
Equation bilan de la réaction chimique (combustion), Formule générale d’un alcane non-cyclique :
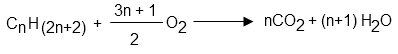
La combustion incomplète d’un alcane produit du carbone solide et de l’eau.
Equation bilan de la combustion (alcane non-cyclique) :
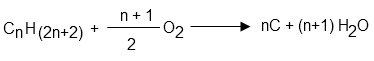
Une question ? Rendez-vous sur le forum