1. Atomes
L’atome est l’élément de base de toute matière. Ce qui signifie que chaque matière est faite à base d’atomes. Par exemple, pour obtenir une goute d’eau, il faut plusieurs millions d’atomes hydrogène et d’atomes d’oxygène.
L’atome est une particule extrêmement petite. Son diamètre est d’environ 0,1 nm. Il est constitué d’un noyau autour duquel gravitent des électrons. Il se trouve un vide entre les électrons et le noyau : on dit que l’atome a une structure lacunaire.
La taille du noyau de l’atome est d’environ 10-15 m.
1.1. Les nucléons
Le noyau d’un atome est constitué des nucléons : les protons et les neutrons.
Un proton est une particule chargée positivement. Sa charge est notée +e ou qp. Elle est de 1,6 x 10-19 C. Sa masse est 1,67 x 10-27 kg.
Un neutron est une particule électriquement neutre, c'est-à-dire que sa charge électrique est nulle. Sa masse est sensiblement égale à celle du proton : 1,67 x 10-27 kg.
1.2. Les électrons
L’ensemble des électrons en mouvement autour du noyau forme le nuage électronique.
Un électron est une particule chargée négativement. Sa charge est notée –e ou qe. Elle est de -1,6 x 10-19 C.
Dans un atome, il y a autant d’électrons que des protons. Donc l’atome est électriquement neutre.
La masse d’un électron est d’environ 9,1 x 10-31 kg. Elle est beaucoup plus négligeable par rapport à la masse du noyau (la masse d’un électron est 2000 fois inferieur qu’à la masse d’un proton ou d’un neutron). On en déduit donc que la masse d’un atome est concentrée sur son noyau.
1.3. Présentation d’un atome
Un atome est représenté ainsi :
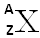
X : est le symbole de l’élément.
A : représente le nombre de masse (nombre de protons + nombre de neutrons)
Z : désigne le numéro atomique (nombre de protons)
Exemple : le fer
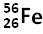
1.4. Les isotopes
Des atomes sont isotopes s’ils ont le même numéro atomique (Z) mais avec des nombres de masse (A) différents.
1.5. Les couches électroniques
Les électrons qui gravitent autour du noyau de l’atome forment des couches électroniques qui sont notées K, L, M, N etc. Le nombre des couches dépendent du nombre d’électrons.
K est la couche la plus proche du noyau. Elle prend au maximum deux électrons. L est la couche suivante. Elle prend au maximum 8 électrons. M prend au maximum 18 électrons.
Pour la distribution des électrons dans les couches, la première (K) doit être d’abord saturée. Et s’il reste des électrons, on les attribue à la couche suivante ainsi de suite.
Exemple :
Si on a un atome qui possède 3 électrons, K aura 2 électrons et L aura 1 électron.
Si on a un atome qui possède 24 électrons, K aura 2 électrons, L aura 18 électrons et M aura 4 électrons.
Si nous prenons l’exemple d’un atome de fer avec ses 26 électrons, K a 2 électrons, L a 18 électrons et M a 6 électrons.
2. Les ions
Un ion est un atome qui a gagné ou perdu un ou plusieurs électrons.
S’il gagne des électrons, il devient un anion (ion négatif).
Si l’atome perd des électrons, il devient un cation (ion positif).
Quelques exemples :
Cu2+ : ion cuivre II est un cation car l’atome de cuivre a perdu 2 électrons.
Fe2+ : ion fer II est un cation car l’atome de fer a perdu deux électrons.
Fe3+ : ion fer III est un cation car l’atome de fer a perdu trois électrons.
H+ : ion hydrogène est un cation car l’atome d’hydrogène a perdu un électron
Ag+ : ion argent est un cation car l’atome d’argent a perdu un électron
Cl- : ion chlore est un anion car l’atome de chlore a gagné un électron.