1. Introduction :
La première pile électrique fut créé en 1799 (1800 pour certains) par un physicien italien connu sous le nom de Volta. L’idée lui vint à partir d’une expérience décrit par Galvani en 1791. Galvani avait constaté qu’un muscle de grenouille se contracte lorsqu’on relie deux de ses points par une chaîne formée de deux métaux différents.
Volta refit la même expérience mais en utilisant sa langue à place du muscle de grenouille. Il constata en effet que si on met en contacte la langue avec deux métaux différents reliés entre eux par un fil conducteur, on éprouve une sensation variable avec les métaux. Cette expérience lui poussa à créer un objet qui a révolutionné le monde : la pile électrique.
La pile de Volta s’git d’un assemblage de disques de zinc et de cuivre. Chaque couple de disques (zinc/ cuivre) était séparé par une rondelle de drap imbibée par une solution conductrice (souvent de l’eau salée).
2. Une transformation chimique produit de l’énergie
Schéma de l’expérience :
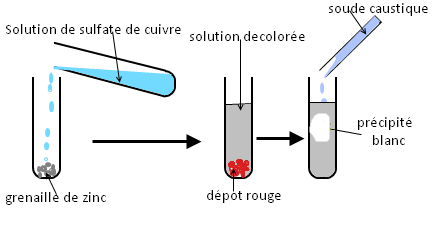
On met de la solution de sulfate de cuivre dans un tube à essaie et on prélève sa température. Après on mélange la solution avec de la grenaille de zinc.
Constat :
Ensuite on sépare le dépôt rouge de la solution décolorée et on verse quelques gouttes de solution de soude caustique dans la solution.
Constat :
Apparition d’un précipité blanc.
Ce qui s’est réellement passé :
Cu2++ 2e_ Cu
Zn Zn2+ + 2e_
· L’équation bilan de cette réaction chimique est :
Cu2+ + Zn Zn2+ + Cu
3. Réalisation d’une pile électrique
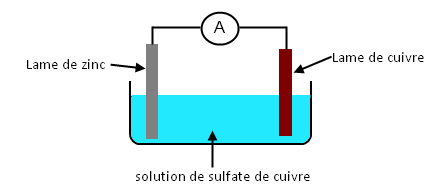
Dans une cuve en verre, on met une solution de sulfate de cuivre. On ajoute ensuite une lame de cuivre et une lame de zinc. On relie les deux lames métalliques à un ampèremètre.
Constat :
L’ampèremètre indique la présence d’un courant électrique.
Cette fois-ci, une partie de l’énergie chimique des réactifs est transformée en énergie électrique.
Nous venons donc de réaliser une pile électrique. La lame de cuivre constitue la borne positive, la lame de zinc constitue la borne négative.
4. La pile consomme du zinc
Une pile électrique, que vous l’utilisiez ou non, finira par s’épuiser car elle consomme du zinc.
On sait très bien que le zinc placé dans une solution de sulfate de cuivre se transforme en ion zinc II. Dans une pile électrique, une fois que cette transformation sera presque complète, la pile cessera de fonctionner.
Une pile consomme beaucoup plus du zinc lorsqu’elle débite un courant électrique dans un circuit extérieur. Les électrons cédés par le zinc sortent de la borne négative, traversent le circuit extérieur et entrent dans la pile par la borne positive.
5. Des différents types de pile
Depuis l’invention de la pile de Volta, plusieurs recherches et découvertes ont permis de mettre sur le marché plusieurs modèles de pile. Cependant toutes ces piles électrochimiques sont basées sur le même principe de fonctionnement que la pile de Volta.
a. La pile saline
Elle est la pile la plus rependue et moins chère. Elle est moins performante. Son électrolyte est un électrolyte du pont salin.
b. La pile alcaline
Elle ressemble trop à la pile saline sauf qu’elle est plus performante et plus chère que cette dernière. Son électrolyte est un composé alcalin.
c. La pile au lithium
Elle est la pile la plus performante et la plus chère qu’on peut trouver sur le marché. Elle a une forme plate et ressemble souvent à une pièce de monnaie (argent). Elle est utilisée dans les montres, calculatrices, ordinateurs etc.